Cara Kerja Baterai
Bagaimana cara kerja baterai? Sebelum menjawab pertanyaan tersebut, coba Anda bayangkan bagaimana jika seluruh perangkat yang menggunakan listrik harus tercolok ke terminal listrik. Senter, handphone, remot TV, dan perangkat portable lainnya akan terpasang ke stopkontak, sangat tidak praktis. Untungnya, ada baterai yang bisa memberikan kita sumber listrik bergerak yang memberikan banyak kenyamanan di era modern saat ini.
Meskipun ada banyak jenis baterai, konsep dasar cara kerja baterai dan fungsinya tetaplah sama. Bila suatu perangkat terhubung ke baterai, terjadi sebuah reaksi yang menghasilkan energi listrik, dikenal sebagai reaksi elektrokimia. Fisikawan Italia Count Alessandro Volta pertama kali menemukan proses ini pada tahun 1799 saat ia membuat baterai sederhana dari plat logam dan karton/kertas yang direndam air garam. Sejak saat itu, para ilmuwan telah memperbaiki rancangan asli Volta untuk membuat baterai yang terbuat dari berbagai macam material dalam berbagai ukuran.
Hari ini, baterai ada di sekitar kita. Baterai menghidupkan jam tangan kita, jam dinding, remote TV, membuat lampu senter kita berfungsi, bahkan ketika listrik mati. Jika Anda membaca artikel ini di laptop atau smartphone Anda, mungkin saat ini Anda juga sedang merasakan manfaat dari sebuah baterai. Namun, tahukah Anda bagaimana cara kerja baterai yang sudah sangat kita rasakan manfaatnya tersebut? Artikel ini akan memberi Anda informasi tentang sebuah baterai dengan mengeksplorasi sejarah baterai, serta bagian dasar, reaksi dan proses yang membuat baterai bekerja.
Sejarah Baterai
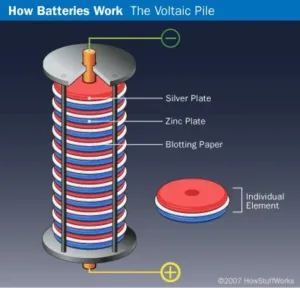 Pada tahun 1938, arkeolog Wilhelm Konig menemukan beberapa bejana tanah liat aneh saat menggali di Khujut Rabu, tepat di luar Baghdad sekarang, Irak. Sebuah bejana, yang berukuran panjang sekitar 5 inci (12,7 sentimeter), berisi batang besi yang terbungkus tembaga yang diperkirakan dari tahun 200 SM. Hasil pengujian menunjukkan bahwa bejana tersebut pernah diisi dengan zat asam seperti cuka atau anggur, yang menyebabkan Konig percaya bahwa bejana tersebut adalah sebuah baterai kuno. Sejak penemuan tersebut, para ilmuwan telah membuat replika bejana yang sebenarnya mampu menghasilkan muatan listrik itu. “Baterai Baghdad” tersebut mungkin telah digunakan untuk ritual keagamaan, tujuan pengobatan, atau bahkan lempeng listrik.
Pada tahun 1938, arkeolog Wilhelm Konig menemukan beberapa bejana tanah liat aneh saat menggali di Khujut Rabu, tepat di luar Baghdad sekarang, Irak. Sebuah bejana, yang berukuran panjang sekitar 5 inci (12,7 sentimeter), berisi batang besi yang terbungkus tembaga yang diperkirakan dari tahun 200 SM. Hasil pengujian menunjukkan bahwa bejana tersebut pernah diisi dengan zat asam seperti cuka atau anggur, yang menyebabkan Konig percaya bahwa bejana tersebut adalah sebuah baterai kuno. Sejak penemuan tersebut, para ilmuwan telah membuat replika bejana yang sebenarnya mampu menghasilkan muatan listrik itu. “Baterai Baghdad” tersebut mungkin telah digunakan untuk ritual keagamaan, tujuan pengobatan, atau bahkan lempeng listrik.
Pada tahun 1799, fisikawan Italia Alessandro Volta menciptakan baterai pertama dengan menumpuk lapisan bergantian antara seng, karton/kain yang direndam air garam, dan perak. Pengaturan ini atau yang disebut dengan tumpukan volta, bukanlah alat pertama yang menciptakan listrik, tapi ini adalah alat pertama yang memancarkan arus listrik yang stabil. Namun, ada beberapa kelemahan dari penemuan Volta. Ketinggian di mana lapisan bisa ditumpuk terbatas karena berat tumpukan akan memeras air asin keluar dari karton atau kain. Cakram logam juga cenderung berkorosi dengan cepat, memperpendek umur baterai. Terlepas dari kekurangan ini, satuan SI gaya gerak listrik sekarang disebut volt untuk menghormati pencapaian Volta.
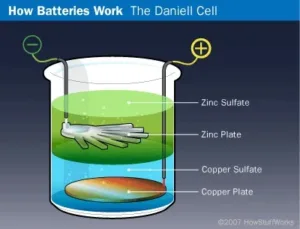 Terobosan berikutnya dalam teknologi baterai datang tahun 1836 ketika ahli kimia Inggris John Frederick Daniell menemukan sel Daniell. Pada baterai awal ini, plat tembaga diletakkan di dasar stoples kaca dan larutan tembaga sulfat dituangkan di atas plat untuk mengisi setengah botol. Kemudian plat seng digantungkan di dalam toples, dan larutan seng sulfat ditambahkan. Karena tembaga sulfat lebih padat dari seng sulfat, larutan seng melayang ke bagian atas larutan tembaga dan mengelilingi plat seng. Kabel yang terhubung ke plat seng mewakili terminal negatif, sedangkan yang mengarah dari plat tembaga adalah terminal positif. Jelas, pengaturan ini tidak akan berfungsi dengan baik pada senter, tapi untuk penerapan stasioner, hasilnya berjalan baik. Sebenarnya, sel Daniell adalah cara yang biasanya digunakan untuk menyalakan bel pintu dan telepon sebelum pembangkit listrik disempurnakan.
Terobosan berikutnya dalam teknologi baterai datang tahun 1836 ketika ahli kimia Inggris John Frederick Daniell menemukan sel Daniell. Pada baterai awal ini, plat tembaga diletakkan di dasar stoples kaca dan larutan tembaga sulfat dituangkan di atas plat untuk mengisi setengah botol. Kemudian plat seng digantungkan di dalam toples, dan larutan seng sulfat ditambahkan. Karena tembaga sulfat lebih padat dari seng sulfat, larutan seng melayang ke bagian atas larutan tembaga dan mengelilingi plat seng. Kabel yang terhubung ke plat seng mewakili terminal negatif, sedangkan yang mengarah dari plat tembaga adalah terminal positif. Jelas, pengaturan ini tidak akan berfungsi dengan baik pada senter, tapi untuk penerapan stasioner, hasilnya berjalan baik. Sebenarnya, sel Daniell adalah cara yang biasanya digunakan untuk menyalakan bel pintu dan telepon sebelum pembangkit listrik disempurnakan.
Pada tahun 1898, Colombia Dry Cell menjadi baterai komersial pertama yang dijual di Amerika Serikat. Produsennya, National Carbon Company, kemudian menjadi Eveready Battery Company, yang memproduksi merek Energizer.
Anatomi Baterai
Lihatlah baterai apa saja, Anda akan melihat ada dua terminal. Satu terminal bertanda (+), atau positif, sedangkan yang lainnya bertanda (-), atau negatif. Jika Anda menghubungkan kabel antara dua terminal, elektron akan mengalir dari ujung negatif ke ujung positif secepat mereka bisa. Itu akan cepat menghabiskan baterai dan juga bisa berbahaya, terutama pada baterai dengan kapasitas besar. Untuk memanfaatkan muatan listrik yang dihasilkan baterai dengan benar, Anda harus menghubungkannya ke sebuah beban. Bebannya bisa berupa bola lampu, motor listrik, atau sirkuit elektronik seperti radio.
Cara Kerja Baterai
 Listrik, seperti yang mungkin sudah Anda ketahui, adalah aliran elektron melalui jalur konduktif seperti kawat. Jalan ini disebut sirkuit.
Listrik, seperti yang mungkin sudah Anda ketahui, adalah aliran elektron melalui jalur konduktif seperti kawat. Jalan ini disebut sirkuit.
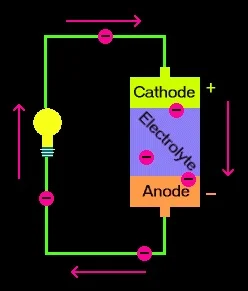
Baterai memiliki tiga bagian, anoda (-), katoda (+), dan elektrolit. Katoda dan anoda (sisi positif dan negatif pada kedua ujung baterai tradisional) dihubungkan ke sirkuit listrik.
Reaksi kimia dalam baterai menyebabkan terbentuknya elektron pada anoda. Hal ini menghasilkan perbedaan listrik antara anoda dan katoda. Anda bisa memikirkan perbedaan ini sebagai penumpukan elektron yang tidak stabil. Elektron ingin mengatur ulang diri untuk menyingkirkan perbedaan ini. Tapi mereka melakukan ini dengan cara tertentu. Elektron saling tolak-menolak dan mencoba pergi ke tempat dengan sedikit elektron.
Pada baterai, satu-satunya tempat yang harus ditempuh adalah katoda. Tapi, elektrolit membuat elektron tidak bergerak langsung dari anoda ke katoda di dalam baterai. Bila sirkuit tertutup (kawat menghubungkan katoda dan anoda) elektron akan bisa sampai ke katoda. Pada gambar di atas, elektron melewati kawat, menyalakan bohlam di sepanjang jalan. Inilah salah satu cara untuk menggambarkan bagaimana potensi listrik menyebabkan elektron mengalir melalui sirkuit.
Namun, proses elektrokimia ini mengubah bahan kimia di anoda dan katoda sehingga membuat mereka berhenti memasok elektron. Jadi daya yang tersedia di dalam baterai terbatas.
Material Kimia Baterai
Baterai modern menggunakan berbagai bahan kimia untuk membuatnya, antara lain:
- Baterai seng-karbon: Kimia seng-karbon biasa digunakan pada baterai kering AAA, AA, C, dan D. Anodanya dari seng, katodanya mangan dioksida, dan elektrolitnya adalah amonium klorida atau seng klorida.
- Baterai alkalin: Kimia ini juga umum digunakan pada baterai kering AA, C, dan D. Katoda terdiri dari campuran mangan dioksida, sedangkan anoda adalah bubuk seng. Baterai ini mendapat penamaan dari elektrolit potassium hydroxide, yang merupakan zat alkali.
- Baterai lithium-ion (bisa diisi ulang): Kimia litium sering digunakan pada perangkat berperforma tinggi, seperti ponsel, kamera digital, dan bahkan mobil listrik. Berbagai zat digunakan dalam baterai lithium, namun kombinasi yang umum adalah katoda oksida cobalt lithium dan anoda karbon.
- Baterai timbal-asam (bisa diisi ulang): Ini adalah kimia yang digunakan pada baterai mobil biasa. Elektroda biasanya terbuat dari timbal dioksida dan timbal logam, sedangkan elektrolitnya adalah larutan asam sulfat.
Sumber artikel bagaimana cara kerja baterai.
news via inbox
Nulla turp dis cursus. Integer liberos euismod pretium faucibua








